Hiđro sunfua- lưu huỳnh đioxxit- Lưu huỳnh trioxit
A. Hiđro sunfua
I. Tính chất vật lí
- Là chất khí rất độc, không màu, mùi trứng thối, hơi nặng hơn không khí, tan ít trong nước(độ tan S=0,38 g/100 g nước ở 200C và 1 atm)
- Hóa lỏng ở -600C
- Hóa rắn ở - 860C
II. Tính chất hóa học
1. Tính axit yếu
H2S tan trong nước tạo thành d.d axit yếu

H2S + 2NaOH → Na2S + 2H2O
(Natri sunfua)
Đặt
+) T ≤1: Tạo muối hiđrosunfua
+) 1 <T< 2 Tạo cả 2 muối hiđrosuafua và sunfua
+) T ≥ 2: Tạo muối sunfua
2. Tính khử mạnh
– Oxi hóa chậm (thiếu oxi)
– Ở nhiệt độ cao H2S cháy trong không khí với ngọn lửa xanh tạo SO2
– Phản ứng của H2S với chất oxi hóa mạnh
* Lưu ý: H2S có khả năng làm mất màu dung dịch brom và dung dịch thuốc tím
III. Trạng thái tự nhiên và điều chế
1. Trạng thái tự nhiên
Có trong 1 số nước suối, khí núi lửa, chất protein bị thối rữa, ...
2. Nguyên tắc điều chế H2S trong phòng thí nghiệm :
- Cho muối sunfua (trừ PbS, CuS,…) + dung dịch axit mạnh.
* Lưu ý:
– Các muối sunfua của kim loại nhóm IA, IIA (trừ Be) tan trong nước.
– Các muối sunfua của Pb, Cu,… không tan trong axit mạnh như HCl, H2SO4 loãng.
– Các muối sunfua còn lại (FeS, ZnS,..) không tan trong nước nhưng tan trong axit.
B. Lưu huỳnh đioxit.
I. Tính chất vật lí
- Là khí độc, không màu, mùi hắc, nặng gấp hơn 2 lần không khí.
- Hóa lỏng ở - 100C.
- Tan nhiều trong nước (ở 200C, 1VH2O hòa tan 40VSO2).
II. Tính chất hóa học
1. SO2 là oxit axit
SO2 tan trong nước tạo thành d.d axit yếu

=> khí SO2 có khả năng làm đỏ quỳ tím ẩm
SO2 + NaOH → NaHSO3
(natri hiđrosunfit)
SO2 + 2NaOH → Na2SO3 + 2H2O
(natri sunfit)
* Lưu ý: Xét tỉ lệ để biết muối tạo thành, tương tự như với H2S
* Lưu ý: Sục SO2 vào nước vôi trong (hoặc Ba(OH)2) đến dư thấy xuất hiện kết tủa trắng sau đó kết tủa tan dần thành dung dịch không màu.
* Lưu ý: sục SO2 vào nước vôi trong (hoặc Ba(OH)2) đến dư thấy xuất hiện kết tủa trắng sau đó kết tủa tan dần thành dung dịch không màu.
2. Tính khử mạnh.
– SO2 là chất khử khi tác dụng với chất oxh mạnh
– SO2 là chất oxh khi tác dụng với chất khử mạnh hơn
* Lưu ý: SO2 có khả năng làm mất màu cánh hoa hồng (tính tẩy màu) => dùng để nhận biết khí SO2
III. Ứng dụng và điều chế SO2.
1. Ứng dụng :
- Điều chế H2SO4.
- Tẩy trắng giấy, bột giấy.
- Chống nấm mốc lương thực, thực phẩm.
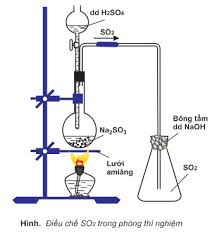
2. Nguyên tắc điều chế SO2 :
- Phòng thí nghiêm.
H2SO4(đ,nóng) + Na2SO3(rắn) → Na2SO4 + H2O + SO2
2H2SO4(đ,nóng) + Cu → CuSO4 + 2H2O + SO2
H2SO4(đặc) + S → 2H2O + 3SO2
- Công nghiệp: Đốt cháy lưu huỳnh hoặc quặng pirit sắt
C. Lưu huỳnh trioxit
I. Tính chất
- Là chất lỏng không màu, tan vô hạn trong nước và trong H2SO4
- Nhiệt độ nóng chảy: 17 0C
- Nhiệt độ sôi : 45 0C
- Là oxit axit:
II. Ứng dụng và sản xuất
- Ít có ứng dụng thực tiễn
- Là sản phẩm trung gian để điều chế H2SO4
- Điều chế trong công nghiệp:
t0,V2O5
2SO2 + O2 → 3SO3











