Phản ứng trao đổi ion trong dung dịch các chất điện li
1.1.ĐIỀU KIỆN XẢY RA PHẢN ỨNG TRAO ĐỔI ION TRONG DUNG DỊCH CÁC CHẤT ĐIỆN LI:
1. Phản ứng tạo thành chất kết tủa:
* Thí nghiệm:
- Nhỏ dd Na2SO4 vào cốc đựng dd BaCl2 → có kết tủa trắng.
* Phương trình dạng phân tử:
Na2SO4+BaCl2 → BaSO4↓+2NaCl
Trắng
* Phương trình ion đầy đủ:
2Na+ + + Ba2++ 2Cl- →BaSO4↓+ 2Na+ + 2Cl-
* Phương trình ion rút gọn:
Ba2+ + SO42- → BaSO4 ↓
→Phương trình ion rút gọn thực chất là phản ứng giữa ion Ba 2+ và SO4 2- tạo kết tủa BaSO4.
2.Phản ứng tạo thành chất điện li yếu:
a. Phản ứng tạo thành nước:
* TN: Dung dịch NaOH phản ứng với dung dịch HCl → H2O.
Pt phân tử:
NaOH + HCl → H2O + NaCl
Pt ion đầy đủ:
Na+ + OH- + H+ + Cl- → H2O + Na+ + Cl-
Phương trình ion rút gọn:
H+ +OH- → H2O
→Phản ứng giữa dd axít và hiđroxít có tính bazơ rất dễ xảy ra vì tạo thành chất điện li rất yếu là H2O
b. Phản ứng tạo thành axít yếu:
* TN: Cho dd HCl vào phản ứng dung dịch CH3COONa.
- Phương trình phân tử:
HCl + CH3COONa → CH3COOH+ NaCl
- Phương trình ion đầy đủ:
H++Cl-+CH3COO-+Na+→ CH3COOH+Na++Cl-
- Phương trình ion thu gọn:
H+ + CH3COO- → CH3COOH.
3. Phản ứng tạo thành chất khí:
* TN: cho dd HCl vào dd Na2CO3 → khí thoát ra.
- Phương trình phân tử:
2HCl + Na2CO3 → 2NaCl+CO2↑ + H2O
- Phương trình ion đầy đủ:
2H+ +2Cl- +2Na+ +CO32-→2Na+ +2Cl- +CO2↑ + H2O
- Phương trình ion thu gọn:
2H++CO32-→CO2↑ + H2O.
1.2.KẾT LUẬN:
- Phản ứng xảy ra trong dd các chất điện li là phản ứng giữa các ion
- Để phản ứng trao đổi ion trong dung dịch các chất điện li xảy ra khi các ion kết hợp được với nhau tạo thành ít nhất một trong các chất sau:
+ Chất kết tủa
+ Chất điện li yếu
+ Chất khí
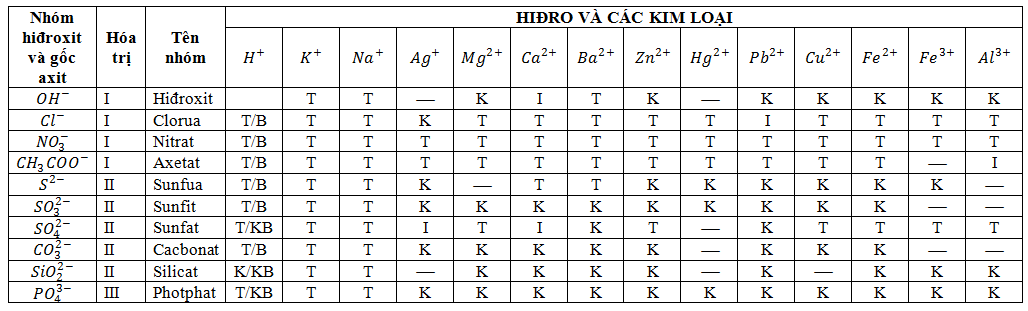
- Có thể dựa vào bảng tính tan để xác định nhanh các phản ứng xảy ra giữa các ion trong dung dịch: