Axit nitric và muối nitrat
A. AXIT NITRIC

I. Cấu tạo phân tử
-CTCT: H-O- N=O
||
O
- Trong phân tử HNO3, N có số oxi hóa là +5
II. Tính chất vật lý:
* Axit nitric tinh khiết là chất lỏng không màu, bốc khói mạnh trong không khí ẩm, D=1,53g/cm3 , sôi ở 860C. Axit nitric tinh khiết kém bền, ngay ở điều kiện thường khi có ánh sáng bị phân hủy một phần giải phóng khí nitơ đioxit (NO2). Khí này tan trong dung dịch axit, làm cho dung dịch có màu vàng.
* Axit nitric tan trong nước theo bất kì tỉ lệ nào.
III. Tính chất hóa học
HNO3 → H+ + NO3- => là axit mạnh
- → Số OXH cao nhất nên chỉ có thể giảm => tính oxi hoá
1. Tính axít : HNO3 là axít mạnh
- Quỳ tím hoá đỏ
- Tác dụng với oxít bazơ, bazơ, muối của các axít yếuà muối nitrat.
2 HNO3 + CuO → Cu(NO3)2 + H2O
2HNO3 +Ca(OH)2 → Ca(NO3)2+2H2O
2HNO3 + CaCO3 → Ca(NO3)2 + CO2 + H2O
2. Tính oxi hoá:
- HNO3 có số OXH + 5 có thể bị khử thành:
o +1 +2 +4 -3
N2, N2O, NO, NO2, NH4NO3 tuỳ theo nồng độ HNO3 và khả năng khử của chất tham gia.
a. Tác dụng với kim loại:
-Oxy hoá hầu hết kim loại (trừ Au, Pt).
0 +5 +2 +2
3Cu +8HNO3(l) →3Cu(NO3)2 + 2NO + 4H2O
0 +5 +2 +4
Cu + 4HNO3đ → Cu(NO3)2 + 2NO2 + 2H2O
- Fe, Al, Cr thụ động hoá với HNO3 đặc, nguội
b. Tác dụng với phi kim:
HNO3 đặc, nóng OXH được một số phi kim C,S,P,... → NO2
+ 4HO3 → O2 + 4O2 + 2H2O
+ 6HO3→ H2O4 + 6O2+ 2H2O
c. Tác dụng với hợp chất:
- HNO3 đặc oxi hoá nhiều hợp chất vô cơ và hữu cơ
FeO + 4HNO3 → Fe(NO3)3 + NO2 + 2H2O
- Vải, giấy, mùn cưa, dầu thông….bị phá huỷ khi tiếp xúc HNO3 đặc
IV. Ứng dụng:
Axit HNO3HNO3 là một trong những hóa chất cơ bản quan trọng. Phần lớn axit HNO3HNO3 sản xuất trong công nghiệp được dùng để điều chế phân đạm NH4NO3,...NH4NO3,... Axit HNO3HNO3 còn được dùng để sản xuất thuốc nổ (thí dụ trinitrotoluen (TNT),...), thuốc nhuộm, dược phẩm,...
V. Điều chế
1.Trong PTN:
Cho tinh thể NaNO3 (hoặc KNO3) tác dụng với H2SO4 đặc, đun nóng
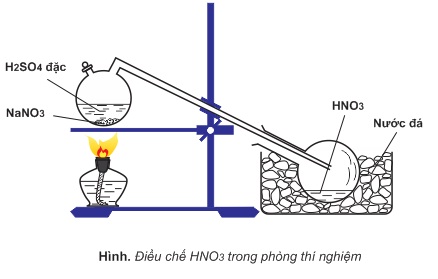
NaNO3 + H2SO4(đ) → HNO3 + NaHSO4
2. Trong CN:

* Sản xuất HNO3 từ NH3, không khí: Gồm 3 giai đoạn
- Oxi hoá khí NH3 bằng oxi kk thành NO:
4NH3+ 5O2 → 4NO +6H2O ΔH < 0
-Oxi hoá NO thành NO2 bằng oxi kk ở điều kiện thường : 2NO + O2 → 2NO2
- NO2 tác dụng với nước và oxi kk tạo HNO3:
4NO2 + O2 + 2H2O → 4HNO3
* Dung dịch HNO3 có nồng độ 52 – 68 %
→ Để HNO3 có nồng độ cao hơn: Chưng cất với H2SO4 đậm đặc.
B. Muối nitrat: M(NO3)x
I. Tính chất của muối nitrat:
1. Tính chất vật lý:
- Tất cả các muối nitrat đều tan trong nước và là chất điện li mạnh.
Ca(NO3)2 → Ca 2+ + 2NO3-
KNO3 → K+ + NO3-
2. Tính chất hoá học:
-Các muối nitrat đều kém bền bởi nhiệt, khi đun nóng muối nitrat có tính OXH mạnh.
-Sản phẩm phân huỷ phụ thuộc vào bản chất của cation kim loại:
* Kim loại đứng trước Mg muối Nitrit + O2
2KNO3 → 2KNO2 + O2
* Từ Mg đến Cu Oxit kim loại + NO2 + O2
2Cu(NO3)2 → 2CuO + 4NO2 + O2
* Kim loại sau Cu Kim loại + NO2 + O2
2AgNO3 → 2Ag + 2NO2 + O2
II. Ứng dụng muối nitrat:
Các muối nitrat được sử dụng chủ yếu để làm phân bón hóa học (phân đạm) trong nông nghiệp như:NH4NO3, NaNO3, KNO3, Ca(NO3)2.
Natri nitrat là hợp chất hoá học có công thức NaNO3. Muối này, còn được biết đến với cái tên, diêm tiêu Chile hay diêm tiêu Peru (do hai nơi này có lượng trầm tích lớn nhất). Natri nitrat được dùng như một chất nguyên liệu; trong phân bón, nghề làm pháo hoa, nguyên liệu của bom khói, chất bảo quản, và như một tên lửa đẩy, cũng như thuỷ tinh và men gốm.
Kali nitrat còn được sử dụng để chế thuốc nổ đen (thuốc nổ có khói). Thuốc nổ đen chứa 75% KNO3.











